Atoommassa & molecuulmassa |
|
doelJe kunt uitleggen wat een atoomnummer is.
Je kunt uitleggen wat atoommassa is. Je kunt uitleggen wat molecuulmassa is. Je kunt de molecuulmassa berekenen. |
uitleg
|
Atoomnummer of atoomgetal
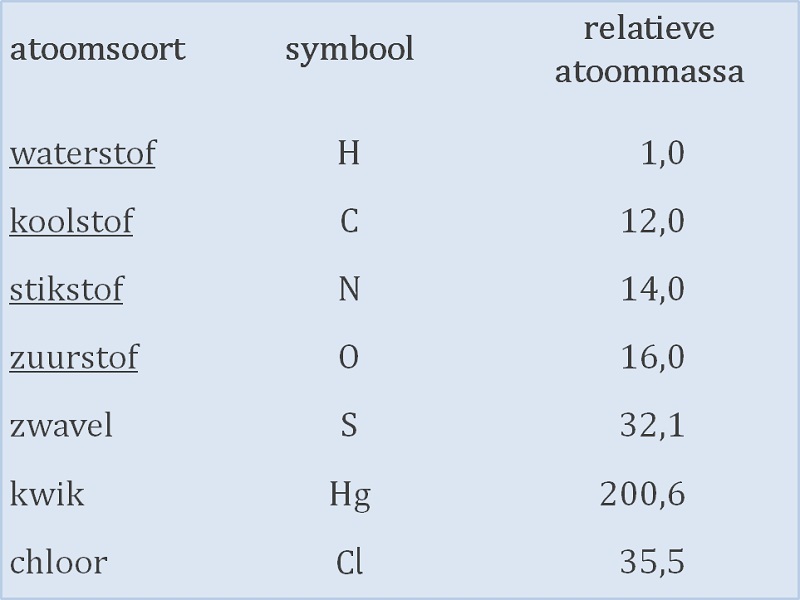
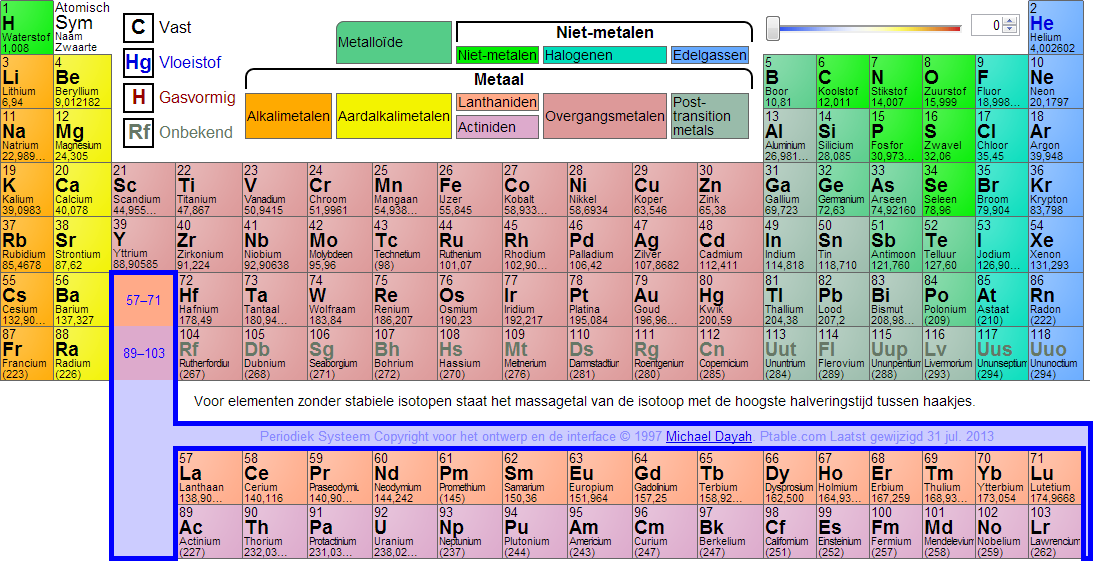
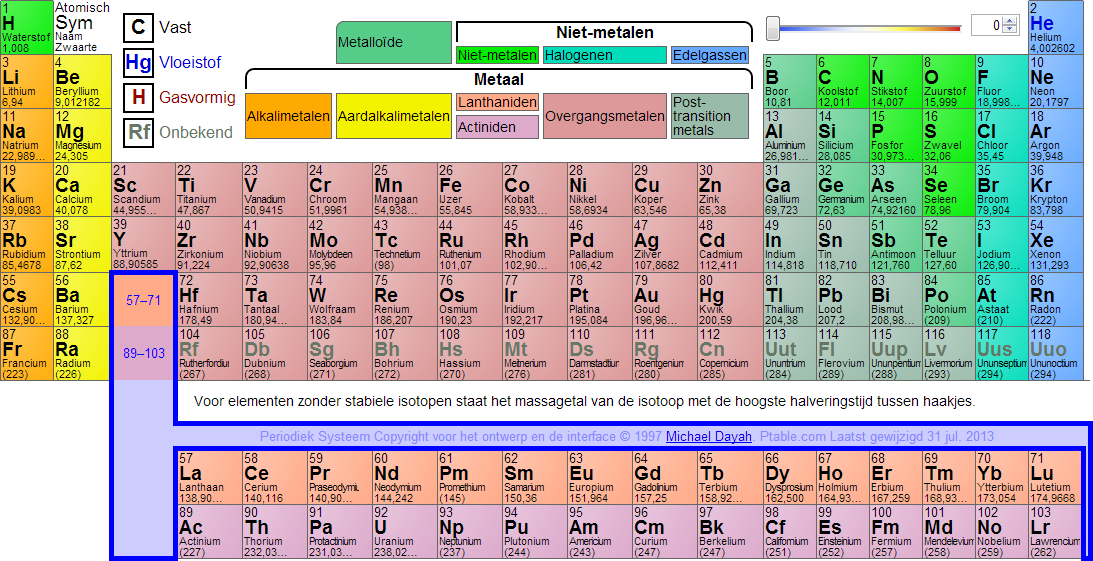
Het atoomnummer of atoomgetal geeft het aantal protonen in de kern van een atoom aan. Het atoomnummer is een belangrijk begrip uit de chemie en de kwantummechanica. Een element en zijn plaats in het periodiek systeem (afbeelding 3) zijn erdoor vastgelegd. Het atoomnummer staat links-boven-in (afbeelding 1). Wanneer het atoom als geheel elektrisch neutraal is, is het atoomnummer gelijk aan het aantal elektronen in de elektronenwolk rond de kern. Juist die elektronen bepalen het chemische gedrag van een atoom. Bij atomen die niet elektrisch neutraal zijn (ionen) is het aantal elektronen ofwel groter dan het atoomnummer (anionen die negatief zijn) ofwel kleiner (bij de positieve kationen). Atoommassa of atomaire massa eenheid De massa van een hoeveelheid stof wordt bepaald door het aantal atomen en de atoomsoorten die in de stof voorkomen. Omdat atomen erg klein zijn wordt de atoommassa niet gemeten in de eenheden gram of kilogram. De eenheid die we gebruiken voor de massa van atomen en moleculen is de atomaire massa -eenheid (u). Men heeft afgesproken dat 12 u gelijk is aan de massa van één koolstof atoom (afbeelding 2). Een koolstof atoom weegt daardoor precies 12 u. |
Van alle andere atoomsoorten is de massa bepaald in vergelijking met die van koolstof. Zo heeft een magnesium atoom ongeveer twee keer zoveel massa als een koolstof atoom. De atoommassa van magnesium is ongeveer 24 u. De atoommassa 's vind je in het periodiek systeem (afbeelding 3). Het periodiek systeem staat ook in je BINAS.
Molecuulmassa
Met de molecuulformule van een stof kun je de relatieve molecuulmassa bepalen. In de molecuulformule staat welke atoomsoorten er in het molecuul voorkomen. Door de index wordt ook aangegeven hoeveel atomen van elk soort er in elk molecuul zitten. Door de atoommassa van alle atomen op te tellen bereken je de molecuulmassa.
Molecuulmassa
Met de molecuulformule van een stof kun je de relatieve molecuulmassa bepalen. In de molecuulformule staat welke atoomsoorten er in het molecuul voorkomen. Door de index wordt ook aangegeven hoeveel atomen van elk soort er in elk molecuul zitten. Door de atoommassa van alle atomen op te tellen bereken je de molecuulmassa.
|
Berekenen van de molecuulmassa
1 - Schrijf de molecuulformule van de stof op. 2 - Schrijf eronder welk atoomsoorten er in het molecuul voorkomen. 3 - Bepaal hoeveel atomen van elk soort in het molecuul voorkomen. 4 - Zoek in binas de atoommassa 's van elk van de atoomsoorten op. 5 - Vermenigvuldig de aantallen met de atoommassa 's 6 - Tel alle berekende massa 's bij elkaar op. |
|
samenvatting
- Het atoomnummer of atoomgetal geeft het aantal protonen in de kern van een atoom aan
- De massa van een hoeveelheid stof wordt bepaald door het aantal atomen en de atoomsoorten die in de stof voorkomen.
- De eenheid van atomaire massa is: u
- De molecuulmassa door de atoommassa van alle atomen op te tellen.
- De massa van een hoeveelheid stof wordt bepaald door het aantal atomen en de atoomsoorten die in de stof voorkomen.
- De eenheid van atomaire massa is: u
- De molecuulmassa door de atoommassa van alle atomen op te tellen.