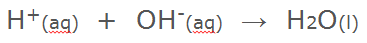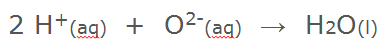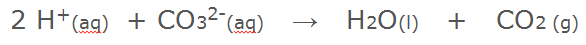basen |
|
doel- Je kunt verschillende soorten Basen noemen.
- Je kunt uitleggen wat een Basen is. - Je kunt de pH schaal lezen. |
uitleg
|
Basen zijn de tegenhangers van zuren. Een zuur kan een waterstof ion (H+) afstaan. Dat maakt het zuur. Een base kan dit waterstof ion opnemen. Hierdoor zijn basen uiterst geschikt om zuren te neutraliseren. Verder kun je met basenvoorwerpen goed ontvetten. Je moet met sterke basen net zo voorzichtig zijn als met sterke zuren. Zelfs zwakke basen zijn al irriterend voor de huid.
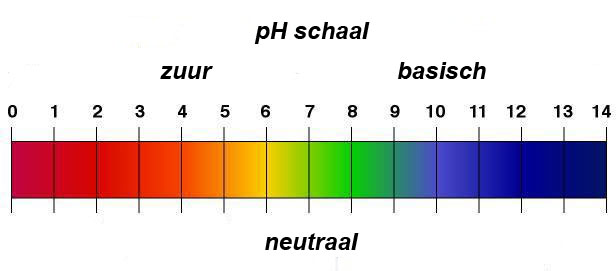
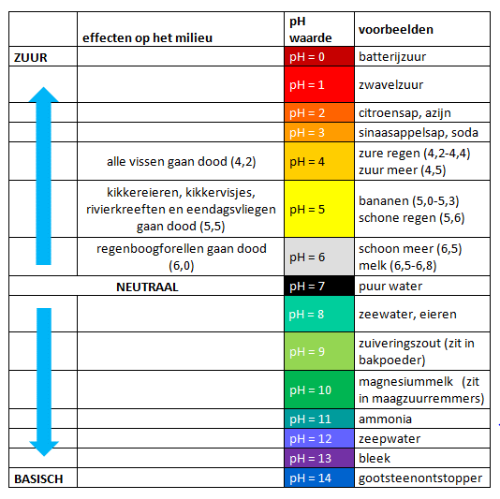
Basen hebben een pH hoger dan 7 (afbeelding 1). In afbeelding 2 zie je voorbeelden van Basen. Hydroxidezouten Alle zouten waar het hydroxide ion in voorkomt, zijn basisch. Bekende voorbeelden zijn natriumhydroxide (NaOH). Moeilijk woord. Beter bekend als gootsteenontstopper (afbeelding 3) of caustische soda, die kleine witte pareltje die je in de gootsteen stopt, beetje warm water er bij en je gootsteen wordt weer gootsteen. Gootsteenontstopper is te verkrijgen bij de drogist of doe het zelf zaak. Kijk wat er op de verpakking staat. Staat daar 99% NaOH (Natriumhydroxide) dan heb je de juiste te pakken. Natronloog is een oplossing van natriumhydroxide in water. Woord van waarschuwing. Caustische Soda is heavy stuff. Het is sterk bijtend en kan ernstige brandwonden veroorzaken. Laat staan als je het spul in je ogen krijgt. Doe daarom uiterst voorzichtig met het spul. Als je natronloog maakt doe dat dan met koud water. Gooi je er warm of heet water op dan maak je kans op een spectaculaire vulkaanuitbarsting en een reisje naar Beverwijk. Niet doen dus.
Uiteraard geldt dus ook hier: buiten bereik van kinderen houden! Krijg je nou natronloog op je huid: geen paniek, niets aan de hand. Afspoelen met veel water of desnoods een beetje azijn. Onze huid is taai genoeg om er eventjes tegen te kunnen. Krijg je het in je ogen of slik je (of iemand) het in ga dan als de wiedeweer naar een dokter en neem het etiket mee. Een ander voorbeeld is kaliumhydroxide (KOH) dat ook wel kaliloog wordt genoemd. Kalkwater wordt gemaakt door calciumhydroxide op te lossen in water. Ook kalkwater is een base omdat het hydroxide ion een waterstof ion kan opnemen. Daarbij ontstaat neutraal water. |
Oxiden
Alle oxiden zijn basisch. IJzer(III)oxide (Fe2O3) is basisch net als magnesiumoxide (MgO). Het oxide ion kan twee waterstof ionen opnemen. Daarbij ontstaat weer neutraal water .
Alle oxiden zijn basisch. IJzer(III)oxide (Fe2O3) is basisch net als magnesiumoxide (MgO). Het oxide ion kan twee waterstof ionen opnemen. Daarbij ontstaat weer neutraal water .
Carbonaatzouten
Alle zouten waar het carbonaat ion in voorkomt, zijn basisch. Het carbonaat ion kan een zuurstof ion afstaan. Daarbij ontstaat CO2 gas. Dit zuurstof ion neemt vervolgens twee waterstof ionen op. Daarbij ontstaat weer neutraal water.
Alle zouten waar het carbonaat ion in voorkomt, zijn basisch. Het carbonaat ion kan een zuurstof ion afstaan. Daarbij ontstaat CO2 gas. Dit zuurstof ion neemt vervolgens twee waterstof ionen op. Daarbij ontstaat weer neutraal water.
samenvatting
links en downloads
|
zuur-base reactie (08:39)
|