chemische reactiesnelheid beïnvloeden |
|
Doel
|
uitleg
|
Stofsoort
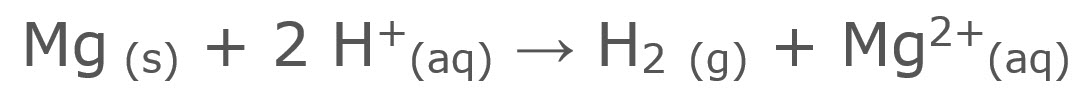
Niet elke chemische reactie gaat even snel. Sommige stoffen willen nu eenmaal liever met elkaar reageren dan anderen (video 1). Magnesium reageert goed met zoutzuur. IJzer reageert ook met zoutzuur maar niet zo heftig. In video 1 wordt eerst magnesiumpoeder met zoutzuur gemengd. Je ziet bellen ontstaan. Deze bellen bestaan uit waterstofgas dat afkomstig is van een reactie tussen waterstofionen en het magnesium. Dezelfde reactie vindt ook plaats bij ijzer, alleen veel minder snel. De soort stof heeft invloed op de reactiesnelheid.
Temperatuur (video 2) Om twee moleculen met elkaar te laten reageren, moeten de twee moleculen elkaar tegenkomen. Hoe warmer een stof is, hoe sneller de moleculen gaan bewegen. Als de temperatuur hoger is, hebben de moleculen meer kans om elkaar tegen te komen. Er zullen in dezelfde tijd meer moleculen reageren. De reactietijd zal hierdoor afnemen. De reactiesnelheid zal hierdoor toenemen. Concentratie (video 3) Een reactie verloopt pas wanneer twee moleculen elkaar tegenkomen. Een hogere concentratie betekent, meer moleculen in dezelfde ruimte. Hierdoor zal de kans toenemen dat twee moleculen elkaar tegenkomen. Er zullen in dezelfde tijd meer moleculen reageren. De reactietijd zal hierdoor afnemen. De reactiesnelheid zal hierdoor toenemen. Verdelingsgraad (video 4) Een reactie verloopt pas wanneer twee moleculen elkaar tegenkomen. Bij een vaste stof kunnen alleen de moleculen aan de buitenkant van de stof reageren. In video.4 wordt magnesium poeder gemend met zoutzuur. Door de stof fijner te verdelen is het oppervlak van de stof groter. Er zijn meer moleculen die in contact kunnen komen met het zoutzuur. Hierdoor zal de kans toenemen dat tweemoleculen elkaar tegenkomen. Er zullen in dezelfde tijd meer moleculen reageren. De reactietijd zal hierdoor afnemen. De reactiesnelheid zal hierdoor toenemen. Katalysator (video 5) Een chemische reactie kun je ook versnellen met een katalysator . Ammoniak wordt gemaakt uit zuurstofgas en waterstofgas. Deze reactie verloopt snel bij hoge temperaturen. Om deze reactie sneller te laten verlopen bij lagere temperaturen wordt ijzeroxide als katalysator toegevoegd. Dit is een stof die wel meedoet aan de reactie maar tijdens de reactie niet verbruikt wordt. De reactietijd zal hierdoor afnemen. De reactiesnelheid zal hierdoor toenemen. |
video 1
video 2
video 3
video 4
video 5
|