elektrolyse |
|
Doel- Je kunt uitleggen hoe elektrolyse werkt.
- Je kunt het toestel van Hofmann beschrijven - Je weet wat een anode en kathode is. - Je kunt verschillende voorbeelden geven van elektrolyse. |
uitleg
|
Wanneer je een elektrische stroom door sommige stoffen laat gaan kunnen deze stoffen uit elkaar vallen in stukjes. Je gebruikt dus elektriciteit voor deze vorm van ontleding. Daarom noemen we dit elektrolyse.
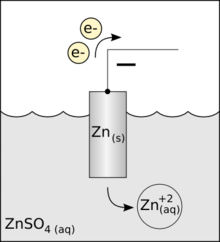
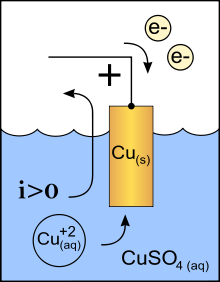
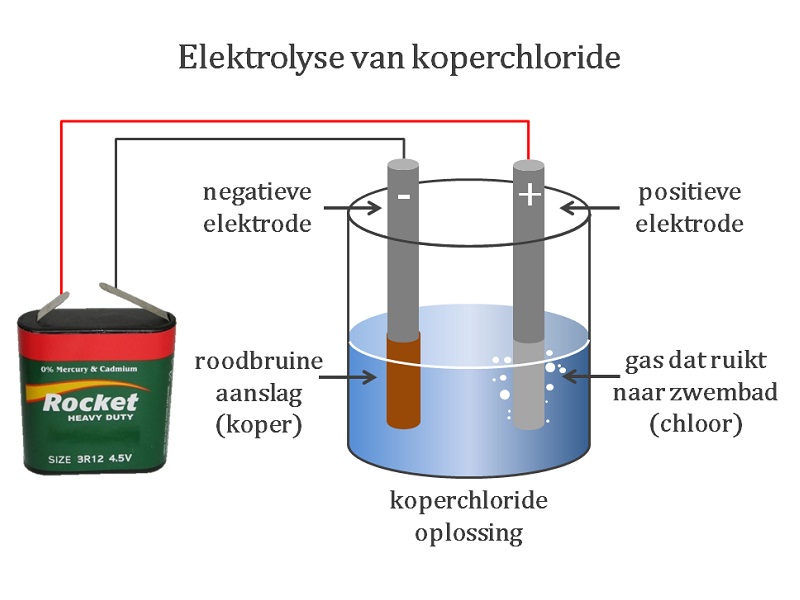
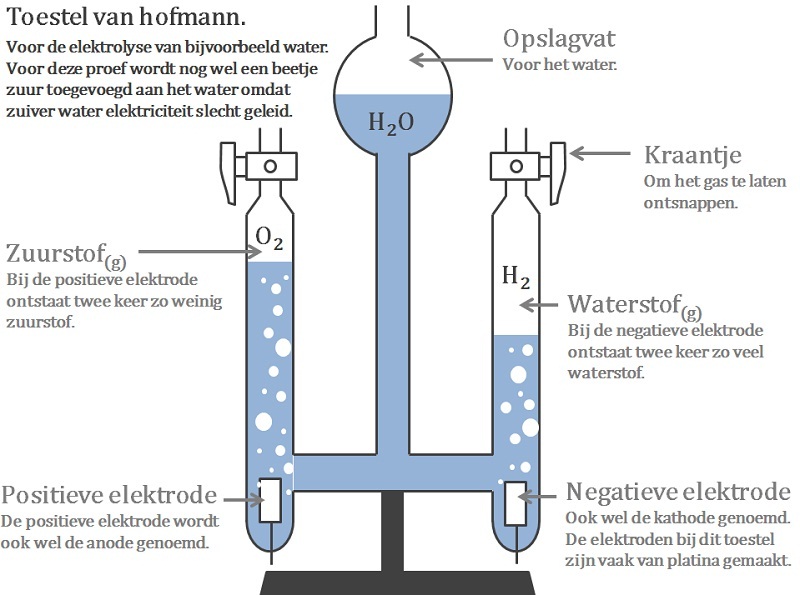
Je gebruikt hiervoor elektroden. Hiervoor worden vaak staafjes gebruikt die gemaakt zijn van koolstof of platina. Maar plaatjes gemaakt van andere metalen werken ook wel. Je steekt twee elektroden in de stof. Door de pluspool en minpool van een spanningsbron op de elektroden aan te sluiten, zien we een chemische reactie ontstaan. Een voorbeeld is de elektrolyse van water (video 1). Bij beide polen ontstaat een gas . Bij de pluspool ontstaat twee keer zoveel gas als bij de minpool. Het gas dat bij de pluspool ontstaat kan ontploffen. Dit is waterstofgas. Het gas bij de minpool laat een stof beter branden. Dit is zuurstof. De positieve elektrode noemen we kathode (afbeelding 1; hier wordt het Zink "weggegeten" en ontstaat zinksulfaat door het wegnemen van elektronen) De negatieve elektrode noemen we anode (afbeelding 2; hier ontstaat vast koper uit kopersulfaat, door het toevoegen van elektronen) Andere voorbeelden zijn de elektrolyse van koperchloride (afbeelding 3) en de winning van aluminium uit de grondstof bauxiet. NB: Er is een verschil in gebruik van de positieve en negatieve pool bij de galvanische cel en de elektrolyse van water: - galvanische cel: kathode = positief en anode = negatief - waterelektrolyse: kathode = negatief en anode = positief (ezelsbruggetje KNAP; Kathode-Negatief; Anode-Posotief) |
samenvatting
- Bij elektrolyse gebruikt je elektriciteit voor het ontleden van vloeistoffen.
- Hierbij worden of 2 gassen gevormd (bij/aan de elektroden) of een gas en een vaste stof.
- Elektroden zijn staafjes die meestal gemaakt zijn van koolstof of platina. (omdat deze niet reageren)
Voorbeelden van elektrolyse:
- Het winnen van zuurstof en waterstof uit water.
- Het winnen van koper en chloorgas uit kopersulfaat.
- Het winnen van aluminium uit bauxiet.
Er is een verschil in gebruik van de positieve en negatieve pool bij de galvanische cel en de elektrolyse van water:
- galvanische cel: kathode = positief en anode = negatief
- waterelektrolyse: kathode = negatief en anode = positief (ezelsbruggetje KNAP; Kathode-Negatief; Anode-Posotief)
Over het algemeen wordt met een Anode de pool of elektrode bedoeld, waar de elektronen uitkomen. Deze is dus Negatief geladen. (Ezelsbruggetje: aNode = de Negatieve elektrode)
De andere elektrode noemen we de Kathode
- De positieve elektrode noemen we anode. (ezelsbruggetje: PA: Positief - Anode)
- De negatieve elektrode noemen we kathode.
- Het Toestel van Hofmann is een opstelling om twee gassen uit een vloeistof te kunnen opvangen.
- Hierbij worden of 2 gassen gevormd (bij/aan de elektroden) of een gas en een vaste stof.
- Elektroden zijn staafjes die meestal gemaakt zijn van koolstof of platina. (omdat deze niet reageren)
Voorbeelden van elektrolyse:
- Het winnen van zuurstof en waterstof uit water.
- Het winnen van koper en chloorgas uit kopersulfaat.
- Het winnen van aluminium uit bauxiet.
Er is een verschil in gebruik van de positieve en negatieve pool bij de galvanische cel en de elektrolyse van water:
- galvanische cel: kathode = positief en anode = negatief
- waterelektrolyse: kathode = negatief en anode = positief (ezelsbruggetje KNAP; Kathode-Negatief; Anode-Posotief)
Over het algemeen wordt met een Anode de pool of elektrode bedoeld, waar de elektronen uitkomen. Deze is dus Negatief geladen. (Ezelsbruggetje: aNode = de Negatieve elektrode)
De andere elektrode noemen we de Kathode
- De positieve elektrode noemen we anode. (ezelsbruggetje: PA: Positief - Anode)
- De negatieve elektrode noemen we kathode.
- Het Toestel van Hofmann is een opstelling om twee gassen uit een vloeistof te kunnen opvangen.