Kookpunt & smeltpunt |
|
Doel- Je kunt uitleggen wat een kookpunt is.
- Je kunt uitleggen wat een smeltpunt is. - Je kunt uitleggen wanneer een vloeistof kookt. - Je kunt uitleggen wat condenseren is. |
uitleg
|
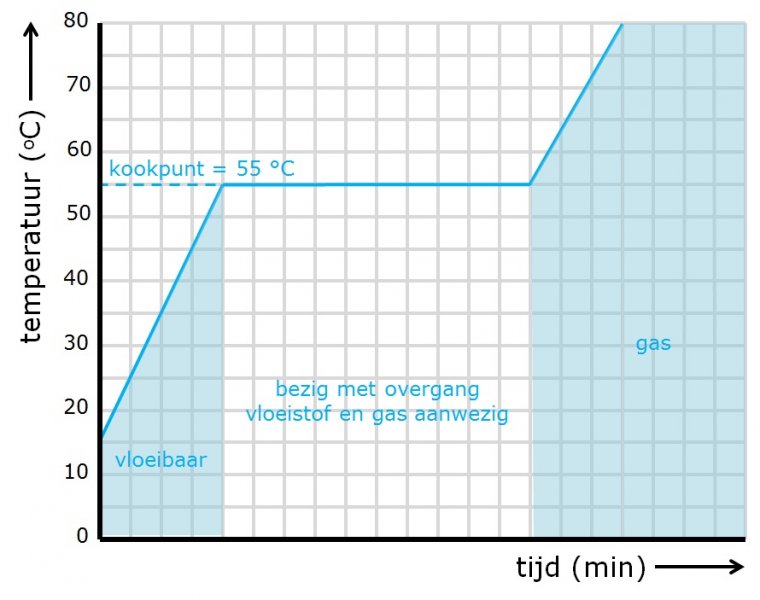
Als je een zuivere vloeistof laat koken blijft de temperatuur tijdens het verdampen gelijk. Dit komt omdat bij precies die temperatuur de aantrekking van de moleculen verbroken wordt. De moleculen raken volledig los van elkaar. De eerste moleculen verlaten aan het oppervlak de vloeistof. Uiteindelijk ontstaan overal in de vloeistof gasbellen. Deze gasbellen zijn gevuld met waterdamp en niet met lucht.
Zie ook: Fase-overgangen |
Condenseren
Als je een zuiver gas afkoelt zie je het omgekeerde gebeuren. De gasmoleculen die in het gas nog vrij bewegen blijven steeds meer aan elkaar kleven als ze elkaar tegen komen. Zolang de temperatuur hoog genoeg is laten ze ook weer los. Als de temperatuur te laag wordt klonteren de gasmoleculen aan elkaar. Ze nemen hierbij niet een vaste plek in maar blijven om elkaar heen draaien. Het gas gaat over in een vloeistof. Dit gebeurt bij dezelfde temperatuur als die van het kookpunt. We noemen het kookpunt daarom ook wel eens het condensatiepunt.
Je kan weten in welke fase een stof is als drie gegevens bekend zijn.
Je moet hiervoor weten:
- Het kookpunt van de stof
- Het smeltpunt van de stof
- De temperatuur die de stof op dat moment heeft
Is de temperatuur van de stof hoger dan zijn kookpunt , dan is de stof gas -vormig.
Is de temperatuur van de stof lager dan zijn smeltpunt , dan is de stof vast.
Zit de temperatuur van de stof tussen zijn kookpunt en zijn smeltpunt in, dan is de stof vloeibaar.
Voorbeeld 1:
Water heeft een smeltpunt van 0°C en een kookpunt van 100°C.
Water is bij 120°C een gas omdat deze temperatuur boven het kookpunt ligt.
Water is bij 65°C een vloeistof omdat deze temperatuur tussen het smelt - en kookpunt ligt.
Water is bij -15°C een vaste stof omdat deze temperatuur onder het smeltpunt ligt.
Voorbeeld 2:
Van de stof zwavelzuur kan je in BINAS tabel 16 opzoeken wat zijn smeltpunt en kookpunt zijn.
Deze twee temperaturen staan wel in Kelvin , die moet je eerst omrekenen.
Het smeltpunt van zwavelzuur is 284 K = 284 - 273 = 11°C en het kookpunt is 603 K = 603 - 273 = 330 °C.
Zwavelzuur is bij 520°C een gas omdat deze temperatuur boven het kookpunt ligt.
Zwavelzuur is bij 140°C een vloeistof omdat deze temperatuur tussen het smelt - en kookpunt ligt.
Zwavelzuur is bij 8°C een vaste stof omdat deze temperatuur onder het smeltpunt ligt.
Als je een zuiver gas afkoelt zie je het omgekeerde gebeuren. De gasmoleculen die in het gas nog vrij bewegen blijven steeds meer aan elkaar kleven als ze elkaar tegen komen. Zolang de temperatuur hoog genoeg is laten ze ook weer los. Als de temperatuur te laag wordt klonteren de gasmoleculen aan elkaar. Ze nemen hierbij niet een vaste plek in maar blijven om elkaar heen draaien. Het gas gaat over in een vloeistof. Dit gebeurt bij dezelfde temperatuur als die van het kookpunt. We noemen het kookpunt daarom ook wel eens het condensatiepunt.
Je kan weten in welke fase een stof is als drie gegevens bekend zijn.
Je moet hiervoor weten:
- Het kookpunt van de stof
- Het smeltpunt van de stof
- De temperatuur die de stof op dat moment heeft
Is de temperatuur van de stof hoger dan zijn kookpunt , dan is de stof gas -vormig.
Is de temperatuur van de stof lager dan zijn smeltpunt , dan is de stof vast.
Zit de temperatuur van de stof tussen zijn kookpunt en zijn smeltpunt in, dan is de stof vloeibaar.
Voorbeeld 1:
Water heeft een smeltpunt van 0°C en een kookpunt van 100°C.
Water is bij 120°C een gas omdat deze temperatuur boven het kookpunt ligt.
Water is bij 65°C een vloeistof omdat deze temperatuur tussen het smelt - en kookpunt ligt.
Water is bij -15°C een vaste stof omdat deze temperatuur onder het smeltpunt ligt.
Voorbeeld 2:
Van de stof zwavelzuur kan je in BINAS tabel 16 opzoeken wat zijn smeltpunt en kookpunt zijn.
Deze twee temperaturen staan wel in Kelvin , die moet je eerst omrekenen.
Het smeltpunt van zwavelzuur is 284 K = 284 - 273 = 11°C en het kookpunt is 603 K = 603 - 273 = 330 °C.
Zwavelzuur is bij 520°C een gas omdat deze temperatuur boven het kookpunt ligt.
Zwavelzuur is bij 140°C een vloeistof omdat deze temperatuur tussen het smelt - en kookpunt ligt.
Zwavelzuur is bij 8°C een vaste stof omdat deze temperatuur onder het smeltpunt ligt.
samenvatting
- Een vloeistof kookt wanneer door de gehele vloeistof gasbellen vormen. Deze gasbellen zijn gevuld met de stof in gasvorm.
- Het smeltpunt en het kookpunt zijn aan elkaar gelijk.
- Het smeltpunt en kookpunt kun je vinden in je BINAS
- Het smeltpunt en het kookpunt zijn aan elkaar gelijk.
- Het smeltpunt en kookpunt kun je vinden in je BINAS
links en downloads
|
| |||||||