zuren |
|
Doel- Je kunt uitleggen wat zuren zijn.
- Je kunt de corrosieve werking van een zuur uitleggen - Je kunt uitleggen wat de PH waarde is. - Je kunt de relatie tussen de concentratie en de H+ ionen toepassen. |
uitleg
Er zijn een heleboel verschillende zuren. Je hebt vast wel eens gehoord van azijnzuur, citroenzuur, koolzuur en misschien wel zoutzuur. Maar er bestaat ook mierenzuur, zwavelzuur,, salpeterzuur en nog veel meer. Al deze zuren hebben een aantal gemeenschappelijke eigenschappen.
|
Bijten, Corrosief
Alle zuren hebben een corrosieve werking. Dat betekent dat ze stoffen aantasten. Vooral metalen worden aangetast door zuren. Sommige kunstenaars gebruiken deze eigenschap. Je kunt zelf ook etsen. Breng een waslaag aan op een stuk metaal en kras er een figuur op. De krassen halen de waslaag weg. Leg het metaal in een zuur en alleen waar geen was zit los het metaal op. Zuren tasten ook kalksteen aan. Deze eigenschap is vooral een probleem bij monumenten die van kalksteen zijn gemaakt (afbeelding.1). Deze worden aangetast door de zure regen. Door deze eigenschap kun je zuren wel héél goed gebruiken om voorwerpen te ontkalken zoals tegels, wasbakken en het bad. |
|
Andere eigenschappen
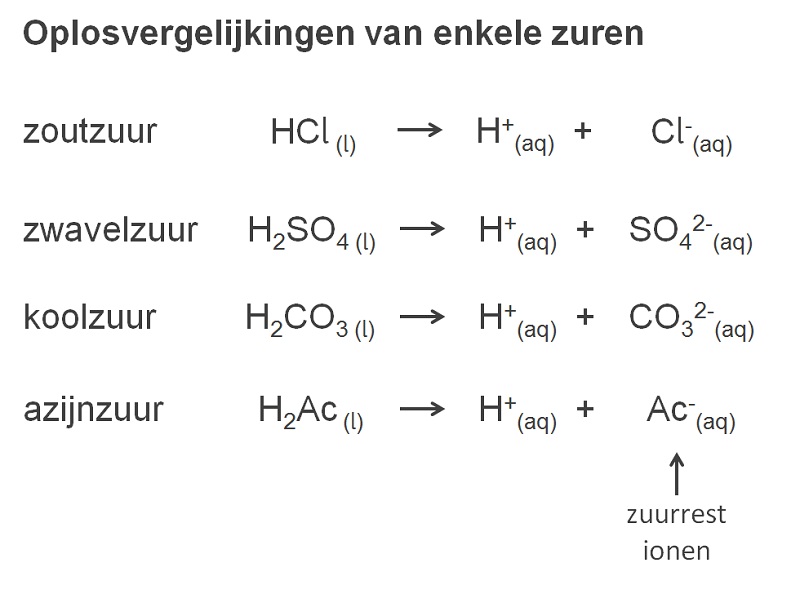
Zuren bestaan uit ionen. Dit betekent dat alle zuren elektriciteit geleiden wanneer je ze oplost in water. Bij de elektrolyse van zuren komt altijd waterstofgas vrij bij de negatieve elektrode. Dit komt omdat het ion dat een stof zuur maakt het H+ ion is. Een stof is zuur zodra het een H+ ion kan afstaan (afbeelding.2). Het negatieve ion dat overblijft noemen we het zuurrest ion. |
Zuurtegraad en H+
De pH-waarde geeft aan hoe zuur een oplossing is. De pH-waarde zegt daarmee iets over de concentratie H+ ionen in de oplossing. De concentratie H+ is het aantal H+ionen dat opgelost is in een volume water, bijvoorbeeld 1 liter.
Als de pH één punt stijgt wordt de concentratie van H+ ionen 10 keer zo groot.
Een oplossing met pH=4 is dus 100 keer zo zuur als een oplossing met pH=6 !!
Als de pH één punt daalt wordt de concentratie van H+ ionen 10 keer zo klein. Een oplossing met pH=9 is dus 10 keer zo basisch als een oplossing met pH=10.
De pH-waarde geeft aan hoe zuur een oplossing is. De pH-waarde zegt daarmee iets over de concentratie H+ ionen in de oplossing. De concentratie H+ is het aantal H+ionen dat opgelost is in een volume water, bijvoorbeeld 1 liter.
Als de pH één punt stijgt wordt de concentratie van H+ ionen 10 keer zo groot.
Een oplossing met pH=4 is dus 100 keer zo zuur als een oplossing met pH=6 !!
Als de pH één punt daalt wordt de concentratie van H+ ionen 10 keer zo klein. Een oplossing met pH=9 is dus 10 keer zo basisch als een oplossing met pH=10.
samenvatting
- Een stof is zuur zodra het een H+ ion kan afstaan.
- Zuren bestaan dus uit ionen.
- Alle zuren hebben een corrosieve werking. Dat betekent dat ze stoffen aantasten. Vooral metalen en kalksteen.
- De pH-waarde geeft aan hoe zuur een oplossing is.
- Hoe lager de pH-waarde (lager dan 7), hoe zuurder het zuur is.
- Voorbeelden van zuren zijn: azijnzuur, citroenzuur, koolzuur en zoutzuur.
- Zuren bestaan dus uit ionen.
- Alle zuren hebben een corrosieve werking. Dat betekent dat ze stoffen aantasten. Vooral metalen en kalksteen.
- De pH-waarde geeft aan hoe zuur een oplossing is.
- Hoe lager de pH-waarde (lager dan 7), hoe zuurder het zuur is.
- Voorbeelden van zuren zijn: azijnzuur, citroenzuur, koolzuur en zoutzuur.