wat is een zout? |
|
Doel
|
uitleg
|
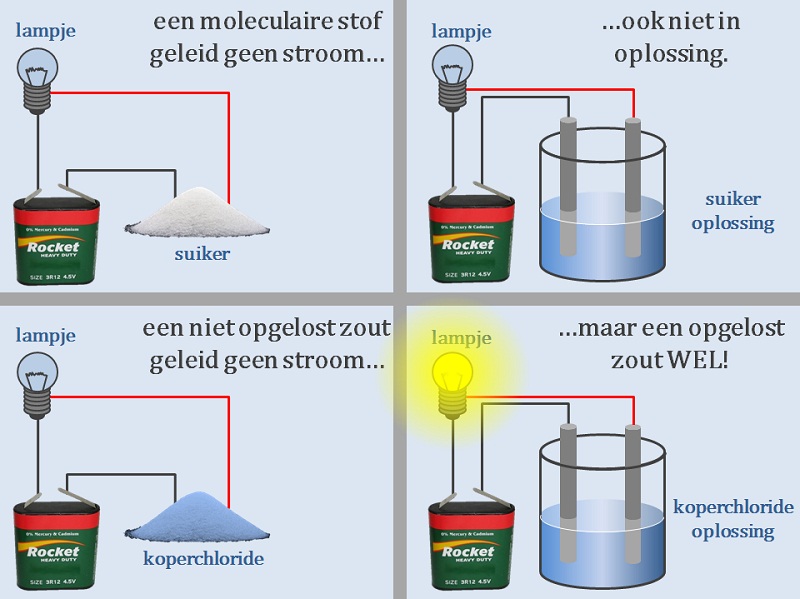
Suiker geleid geen elektrische stroom (afbeelding.1). Ook niet wanneer je het oplost in gedestilleerd water . Keukenzout ook niet. Dat lijkt allemaal misschien logisch. Maar wanneer je keukenzout oplost in gedestilleerd water, geleid de oplossing ineens wel elektriciteit. Stoffen die als vaste stof en in oplossing geen elektriciteit geleiden noemen we moleculaire stoffen.
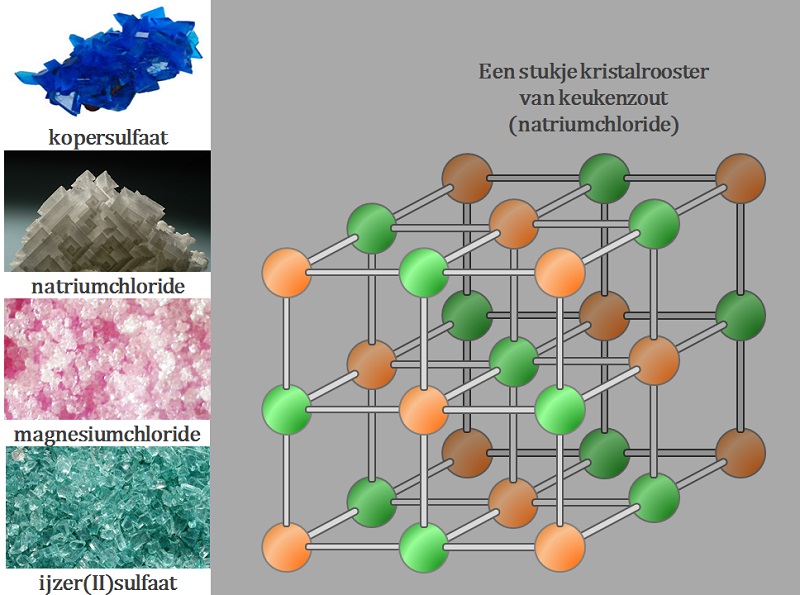
Keukenzout geleidt wel elektriciteit als je het oplost. Er zijn nog veel meer stoffen die elektriciteit geleiden wanneer je ze oplost. Bijvoorbeeld koperchloride (afbeelding 1). Keukenzout en koperchloride horen bij een groep stoffen die scheikundigen zouten noemen. Er zijn honderden zouten met allemaal een aantal gemeenschappelijke eigenschappen. Ionen Alle zouten bestaan uit geladen deeltjes die we ionen noemen. Ionen kunnen positief of negatief geladen zijn. De totale lading van alle positieve ionen samen is altijd net zo groot als de totale lading van alle negatieve ionen . De totale lading van een zout is daarmee altijd nul. Uit welke ionen een zout bestaat en of de lading van die ionen positief of negatief is kun je onderzoeken met elektrolyse. Bij de elektrolyse van koperchloride ontstaat op de negatieve elektrode een roodbruine vaste stof (afbeelding 2). Dit blijkt koper te zijn. Het koper ion moet daarom wel positief zijn. Aan de positieve elektrode ontstaat een gas dat naar chloor ruikt. Het chloor ion moet dus wel negatief zijn. Kristalrooster Alle zouten vormen kristallen wanneer ze in de vaste vorm zijn. Soms zien deze kristallen er prachtig uit, dat ze op edelstenen lijken (afbeelding 3). De kristallenontstaan doordat in een vast zout de ionen op een vaste plek zitten. Ze zitten gerangschikt in een kristalrooster. |
In het kristalrooster trekken de ionen elkaar zo hard aan dat het moeilijk is ze weer uit elkaar te krijgen. Alle zouten hebben daarom ook een hoog smeltpunt. Vaste zouten geleiden geen elektriciteit omdat de ionen niet kunnen bewegen. In opgeloste en gesmolten zouten bewegen de ionen los van elkaar. Daarom kunnen opgeloste of gesmolten zouten wel elektriciteit geleiden.
samenvatting
|